5月26日,中国科学技术大学生命科学与医学部、免疫应答与免疫治疗全国重点实验室梅一德教授团队在Nature Structural & Molecular Biology杂志上发表了题为“Akt-phosphorylated UFL1 UFMylates ArpC4 to promote metastasis”的研究论文,首次揭示了蛋白质犹素化修饰(UFMylation)促进肿瘤转移的分子机制。Nature Structural & Molecular Biology杂志同时以“News & Views”的形式对该论文进行了专文评述。

犹素化修饰是近年来被鉴定的一种新的类泛素化修饰形式。与泛素化修饰类似,犹素化修饰过程依赖E1(UBA5)、E2(UFC1)和E3(UFL1)的三步酶促级联反应,最终将UFM1这一类泛素分子共价连接至底物蛋白上。UFL1是目前已知的该修饰系统中唯一的E3连接酶,UFL1介导的蛋白质犹素化修饰已被报道参与调控基因组稳定性、内质网稳态及免疫应答等过程,然而其在肿瘤转移中的作用及机制尚不清楚。
肿瘤转移作为恶性肿瘤标志性的病理特征,是临床治疗失败和患者死亡的首要原因。在肿瘤的转移过程中,肿瘤细胞迁移被认为是关键的一个环节。细胞迁移的驱动力主要来源于其前沿形成的片状伪足(lamellipodia)。这一动态结构的组装依赖于微丝成核因子Arp2/3复合体介导的肌动蛋白(actin)分支网络的形成。Arp2/3复合体作为调控actin聚合的核心分子机器,由两个actin相关蛋白(Arp2和Arp3)和五个结构亚基(ArpC1-ArpC5)组成,这些高度保守的亚基通过精确的相互作用形成了一个功能完整的蛋白质复合体。
本研究通过建立体外细胞迁移/侵袭模型和体内小鼠肿瘤转移模型,首次发现UFL1能够增强肿瘤细胞的迁移能力、侵袭能力以及体内转移潜能。机制研究表明,在生长因子刺激条件下,UFL1能够定位至细胞的伪足部位,并促进生长因子诱导的伪足形成过程。通过底物筛选和验证实验,研究团队成功鉴定出Arp2/3复合体中的ArpC4亚基是UFL1的关键底物,证实UFL1能够在体内外催化ArpC4发生犹素化修饰,且该修饰对于细胞迁移和肿瘤转移至关重要。在分子机制层面,ArpC4的犹素化修饰通过激活Arp2/3复合体促进伪足形成,从而加速肿瘤转移过程。
本研究还发现在生长因子刺激条件下,AKT激酶可特异性磷酸化UFL1第426位苏氨酸(T426)。这一磷酸化修饰通过增强UFL1与ArpC4的相互作用,促进ArpC4的犹素化修饰,进而驱动细胞伪足形成和肿瘤转移过程。临床肺癌样本分析发现,UFL1 T426位点磷酸化水平与Akt的活化状态(p-Akt水平)呈显著正相关,且随着肺癌临床分期的进展呈现明显升高趋势,这提示了UFL1磷酸化在肿瘤转移中的临床重要性。
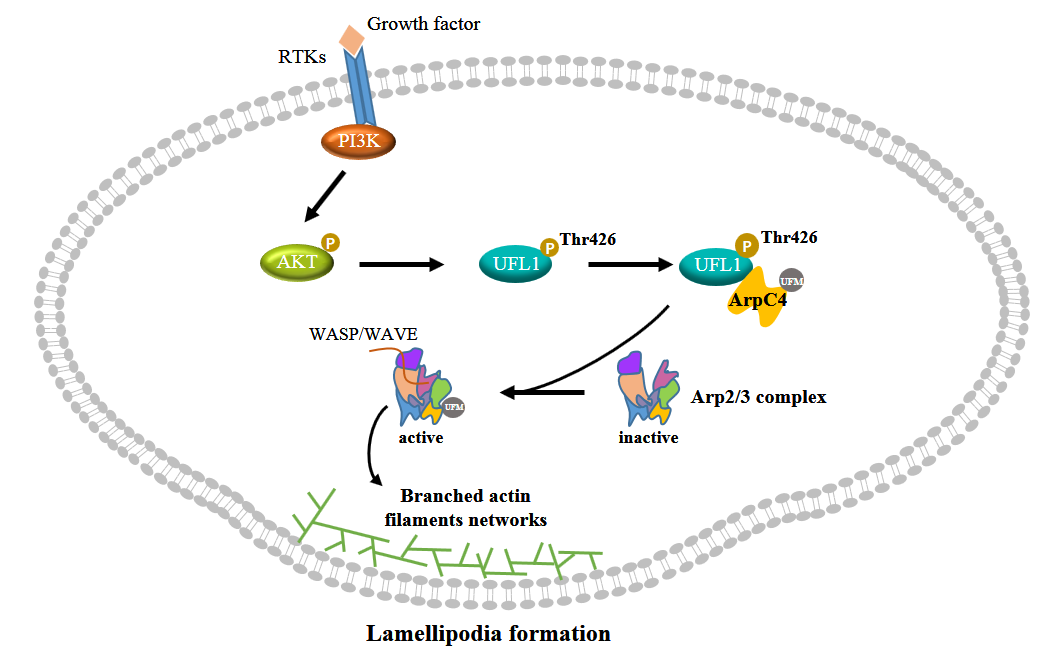
综上所述,本研究揭示了UFL1介导的蛋白质犹素化修饰在肿瘤转移中的重要作用,拓展了人们对犹素化修饰生物学功能的认识,并阐明了"Akt-UFL1-ArpC4"信号轴的分子调控机制。这些发现为深入理解肿瘤的转移过程提供了新的视角,并为靶向犹素化修饰通路的抗肿瘤药物开发提供了潜在的新靶点。
中国科学技术大学特任副研究员赵开亮、已毕业博士生胡昊、博士后方德宝、中科大附一院胸外科解明然主任为论文的共同第一作者,梅一德教授为通讯作者。本研究得到了王朝教授团队的大力帮助。研究获国家自然科学基金、免疫应答与免疫治疗全国重点实验室和合肥综合性国家科学中心大健康研究院等项目的支持。
论文链接:https://www.nature.com/articles/s41594-025-01576-8
