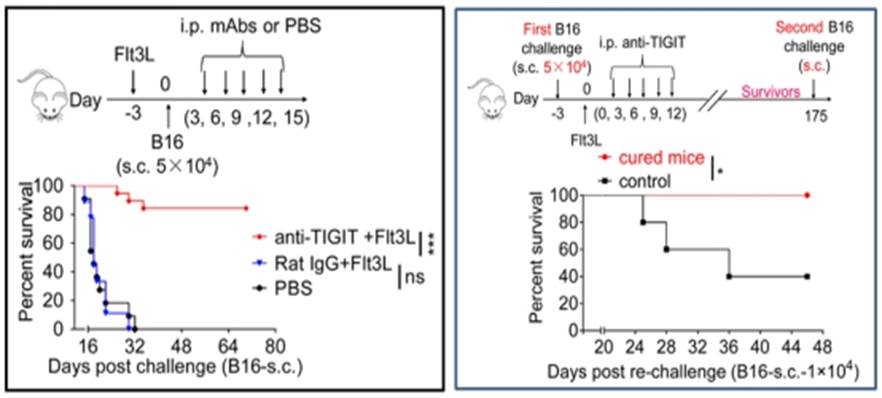
1、发现抗TIGIT单抗可逆转NK细胞耗竭并用于多种肿瘤的免疫治疗(Nature Immunology,2018,19, 723–732 )
6月18日,自然出版集团旗下《Nature Immunology》杂志在线发表了本室田志刚、孙汭教授课题组的研究论文“Blockade of the checkpoint receptor TIGIT prevents NK cell exhaustion and elicits potent anti-tumor immunity”,该项研究成果揭示了肿瘤发展过程中抑制性受体TIGIT可导致NK细胞耗竭,并证明抗TIGIT单抗可逆转NK细胞耗竭并用于多种肿瘤的免疫治疗。
基于卡控点(Checkpoint)的免疫治疗已经成为肿瘤治疗的一线手段,其中PD-1/PD-L1和CTLA-4的阻断治疗在临床上取得了惊人疗效,导致了肿瘤治疗领域的一场大变革。T细胞和NK细胞是机体杀灭癌细胞的二大利器,而目前卡控点免疫治疗主要以逆转T细胞耗竭并进而增强T细胞的杀癌效应为主。该研究小组长期以来极力寻找可导致另一杀癌利器--NK细胞耗竭的抑制性受体,并验证其可否作为肿瘤免疫治疗的靶点(Checkpoint)。TIGIT作为一个新兴的抑制性受体,在NK细胞高度表达,但是在肿瘤发展过程中,TIGIT是否对NK细胞耗竭有重要影响,以及靶向TIGIT的抗体可否逆转NK细胞的耗竭并进而恢复NK细胞的抗肿瘤免疫功能,这些均是研究空白。
课题组通过长期努力,在百余株杂交瘤中获得了几株靶向小鼠TIGIT的高亲和力、阻断型单克隆抗体,在体外试验中证实其对TIGIT受配体结合的强效阻断效应及其对NK细胞的功能提升作用;继而在人和小鼠多种肿瘤模型中(黑色素瘤、乳腺癌、结肠癌等),均发现肿瘤浸润NK细胞高表达TIGIT并伴随NK细胞的功能耗竭;进一步发现在TIGIT特异性缺失小鼠,不易发生NK细胞的功能耗竭,并因此阻滞肿瘤的发生发展;以此为基础,采用抗TIGIT单克隆抗体对荷瘤小鼠进行卡控点免疫治疗,证实基于TIGIT的卡控点免疫治疗能够逆转NK细胞的功能耗竭、增强NK细胞介导的抗肿瘤免疫应答、有效抑制小鼠肿瘤的增长、显著延长荷瘤小鼠的生存;同时,还证实抗TIGIT的卡控点免疫治疗完全依赖于体内NK细胞的存在及其正常的免疫功能,清除NK细胞后该小鼠失去对卡控点免疫治疗的疗效;该研究还证实NK细胞是其它卡控点免疫治疗方案(例如抗PD-L1)取得疗效的前提,NK细胞缺失后会导致CD8+T细胞快速耗竭,而NK细胞的存在能够增强CD8+T的效应功能;采用该TIGIT单克隆抗体治疗成功的小鼠具有近乎终生的强效抗肿瘤免疫记忆,在无任何治疗的情况下,对再次荷瘤具有强大的抵抗力。综上,靶向抑制性受体TIGIT的单克隆抗体可通过强化NK细胞的杀癌功能而行使对肿瘤的免疫治疗,对扩展了解抗癌免疫细胞的类别范围、新型卡控点的寻找、提升现有肿瘤免疫治疗的疗效均有重要意义。
该研究工作得到了国家自然科学基金、国家科技部、中国科学院的资助。通讯作者为中国科大田志刚和孙汭教授,第一作者为中国科大张清博士。
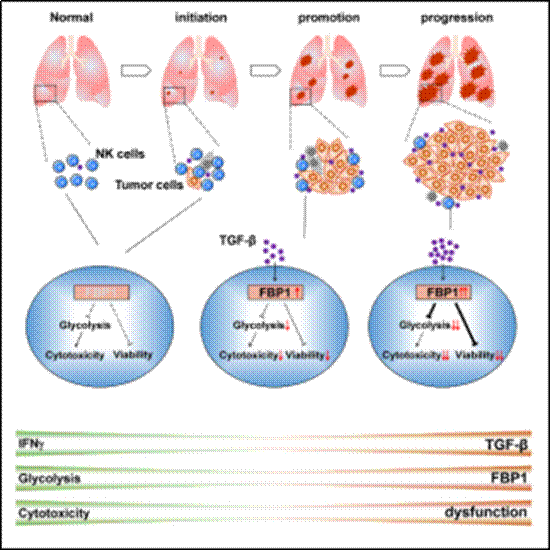
2、发现肿瘤微环境NK细胞代谢失调功能紊乱(Cell Metabolism,2018,28(2),243-255)
2018年7月19日,Cell出版集团旗下代谢学顶级期刊《Cell Metabolism》在线发表了本室魏海明、田志刚教授课题组的研究论文“Dysfunction of Natural Killer Cells by FBP1-induced Inhibition of Glycolysis during Lung Cancer Progression”,该项研究成果展示了肿瘤发生发展过程中自然杀伤细胞(NK细胞)的动态改变,并揭示了一种NK细胞功能紊乱的新机制。
NK细胞是一种效应淋巴细胞,在机体抵抗肿瘤过程中发挥至关重要的作用。NK细胞无需预先致敏,即能够直接杀伤肿瘤细胞,并且能够通过分泌细胞因子促进适应性免疫的抗肿瘤作用。基于上述原理,NK细胞在肿瘤免疫治疗中的价值已得到广泛认可。然而,越来越多的研究表明,肿瘤生长过程中,肿瘤细胞可以通过多种机制诱导NK细胞功能紊乱,从而逃避NK细胞的监视。肿瘤发生发展是一个漫长的过程,主要包括起始期、促进期和进展期三个阶段。而在这整个过程中,NK细胞与肿瘤细胞如何相互作用仍不得而知。
利用Kras突变自发肺癌小鼠模型,课题组证明,在肿瘤起始期,NK细胞有强大的抗肿瘤功能,可以清除大量肿瘤细胞,但是在肿瘤促进期和进展期,NK细胞逐渐丧失了抗肿瘤能力。进一步研究发现,NK细胞丧失抗肿瘤能力与其自身代谢失调密切相关,当肺癌发生后,肿瘤微环境累积大量转化生长因子-b(TGF-β),诱导NK细胞上调表达果糖-1,6-二磷酸酶(FBP1),异常表达的FBP1抑制细胞自身糖酵解代谢,同时破坏细胞存活能力,最终导致NK细胞功能紊乱。抑制NK细胞FBP1的活性,能够恢复NK细胞效应功能、存活能力和体内杀瘤能力。综上,FBP1能够通过抑制NK细胞糖酵解代谢从而削弱NK细胞功能,靶向FBP1提高NK细胞功能可以作为优化NK细胞肿瘤免疫治疗的新策略。
该研究工作得到了国家自然科学基金和中国科学院战略性先导科技专项的资助。通讯作者为中国科大魏海明和田志刚教授,第一作者为中国科大丛靖婧博士。
3、发现长非编码RNA调控细胞DNA修复和细胞衰老(Nat Cell Biol. 2018 April, Vol 20:492-502)
基因组稳定性的维持是一切生命活动的基础,多种外源和内源因素产生的DNA损伤和复制应激,构成了基因组不稳定的主要来源。有最新的研究指出: 人类肿瘤的发生中有高达三分之二的因数要归咎于DNA修复的失调。著名的肿瘤抑制因子p53能够参与DNA修复和维护基因组的稳定,从而抑制肿瘤的形成。长非编码RNA是近年来生命科学领域研究的热点分子,它介导了细胞内各个方面的生物学功能。但是, 是否存在长非编码RNA参与DNA修复和维持基因组稳定,如果存在,它又是如何介导了肿瘤抑制因子p53的DNA修复功能,这些问题的答案迄今仍然不是很清楚。受p53调控的长非编码RNA GUARDIN(这个RNA由吴缅实验室命名,含义是指它像卫士一样护卫基因组的完整),不管在生理稳态或在遭遇毒性应激的条件下,都能参与维护基因组的稳定。GUARDIN同时通过两种机制发挥这种维护作用:1)GUARDIN作为“海绵分子(sponge molecule)”吸附微小RNA 23a (miRNA-23a),促进端粒重复序列结合因子2(TRF2)的表达以此来维持染色体末端结构的完整性;2)GUARDIN可以作为“分子支架”增加BRCA1(乳腺癌1号基因)的稳定性,而BRCA1是基因组双链断裂的修复酶;具体分子机制是GUARDIN可以作为一个支架促进BRCA1与BARD1(BRCA1相关的RING结构域蛋白1)的结合而稳定BRCA1,维持细胞的DNA修复能力。去除GUARDIN表达后会触发细胞凋亡和衰老,同时当GUARDIN表达被抑制后,肿瘤细胞对于靶向DNA损伤的化疗药物(例如Olaparib,一种PARP抑制剂)敏感性会增加,移植瘤的生长被抑制,这意味着GUARDIN具有潜在的抑癌效应,可能成为癌症临床药物治疗的潜在靶标。

4、发现多级复合纳米滴通过增强DNA损伤和抑制其后的修复实现放疗增敏(ACS Nano, 2018, 12 (6), 5684–5698)
王育才教授研究组巧妙设计和制备了载氧的脂质体-金杂化纳米载体用放疗增敏剂以增强放疗对肿瘤的治疗效果。该载体中的超小金颗粒作为高原子序数材料能将离子化能量集中在肿瘤中增强DNA损伤,从而起到放疗增敏的效果。而包载在脂质体-金载体的全氟化碳能够在体外吸收氧气,在超声波的作用下,在肿瘤部位释放出氧气,实现肿瘤部位氧气的运输,有效缓解肿瘤乏氧微环境,抑制放疗后的DNA修复。放疗过程中,联合增强DNA损伤,抑制DNA修复的策略实现多重作用协同,从而增强肿瘤放射治疗效果。此外,该载体可以实现多模态呈像,可用于精准放疗。

5、发展靶向 NLRP3 炎症小体的疾病干预策略(Nat Commun, 2018; EMBO Mol Med, 2018)
NLRP3 炎症小体过度活化在 2 型糖尿病、痛风、神经退行性疾病等重大疾病的发生过程中起重要作用,目前还缺乏直接靶向 NLRP3 的特异性抑制剂。周荣斌课题组和江维课题组建立了 NLRP3 炎症小体抑制剂的筛选体系,鉴定了多个直接靶向 NLRP3 的小分子抑制剂, 主要研究成果如下: 1)发现中草药冬凌草的主要活性小分子冬凌草甲素(Oridonin)也可直接结合 NLRP3并抑制NLRP3炎症小体活化,其可共价结合NLRP3分子上的一个半胱胺酸,从而抑制NLRP3 炎症小体组装和活化,且在 2 型糖尿病、痛风性关节炎等疾病动物模型上表现出较强预防和治疗能力(Nat Commun,2018);2)从临床药物中筛选到一种名为曲尼司特(Tranilast)的治疗过敏的临床药物也可以直接结合 NLRP3 从而抑制其多聚和后续的组装活化,动物实验也表明曲尼斯特同样在 2 型糖尿病、痛风性关节炎等疾病动物模型上表现出很好的预防和治疗潜能(EMBO Mol Med,2018)。 上述研究鉴定了多个直接靶向 NLRP3 的小分子化合物, 为开发相关炎症性疾病的床药物奠定了基础。
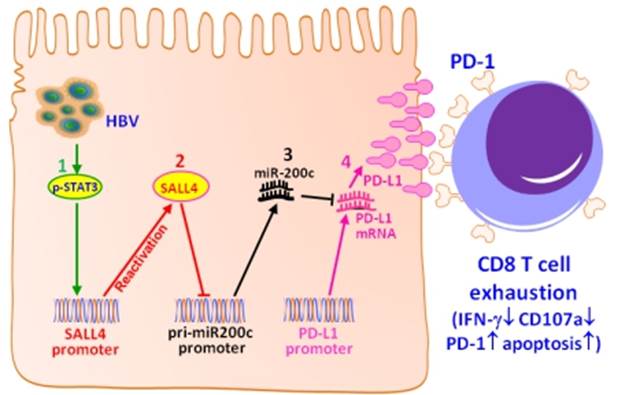
6、发现乙肝病毒导致肝癌的免疫逃逸新机制(Nature Communications,2018,9:1241)
3月28日,自然出版集团旗下《Nature Communications》杂志在线发表了本室田志刚教授课题组与山东大学药学院张彩教授课题组联合攻关的研究论文“Oncofetal gene SALL4 reactivation by hepatitis B virus counteracts miR-200c in PD-L1-induced T cell exhaustion”,该项研究成果揭示了乙肝病毒感染导致机体T淋巴细胞免疫耗竭的新机制。
慢性病毒感染和肿瘤微环境可以诱使机体抗病毒或抗肿瘤特异性T细胞衰竭,使其增殖能力和效应功能严重受损,致使机体免疫应答无法抵抗病毒感染或肿瘤发生。T细胞共抑制受/配体被认为是慢性病毒感染和肿瘤中T细胞耗竭的关键调节因素,据此原理诞生了卡控点免疫疗法(Checkpoint Immunotherapy),成为2013年度世界十大科技进展榜首和美国2016年启动的“癌症登月计划(Cancer MoonShot)”的核心手段。然而,慢性病毒感染、肿瘤发生和介导T细胞耗竭的共抑制受/配体三者之间相互影响的分子机制尚不清楚。
课题组通过HBV+肝癌患者队列进行肝癌组织的分子病理学研究,发现肝癌细胞的锌指转录因子SALL4(一种肝脏胚胎蛋白)和T细胞共抑制配体PD-L1的表达水平均与miR-200c水平呈明显的负相关;通过大样本肝癌病人生存期回顾分析,发现低表达SALL4或PD-L1及高表达miR-200c的患者具有更长的生存期。以HBV+肝癌细胞为模型探讨其分子机制,发现miR-200c可直接靶向PD-L1的3'-UTR以控制其表达,过表达miR-200c能直接抑制HBV诱导的肝细胞PD-L1表达,证实miR-200c是PD-L1表达的阻遏因子;进一步发现HBV感染可以再激活正常成年肝脏不表达的癌胚蛋白SALL4,而SALL4可特异性负向调控miR-200c的转录,使miR-200c失去对PD-L1表达的阻遏作用,导致PD-L1高表达。应用HBV携带小鼠模型进一步确证,HBV可以导致小鼠肝细胞PD-L1高表达,并伴随抗HBV特异性CD8+ T细胞的耗竭;抑制SALL4表达或增强miR-200c表达或用抗体阻断PD-L1均能明显削弱PD-L1介导的T细胞耗竭。课题组首次揭示了在HBV感染和肝癌发展期间存在调节PD-L1表达的HBV-pSTAT3-SALL4-miR-200c-PDL1分子轴,基于该分子轴的干预策略对于逆转病毒或肿瘤诱导的免疫细胞功能衰竭具有重要意义,为Checkpoint免疫治疗提供了新思路。同时,课题组还揭示miR-200c和SALL4可能对HBV+肝癌患者的预后具有预测价值,具有重要的分子病理学意义。
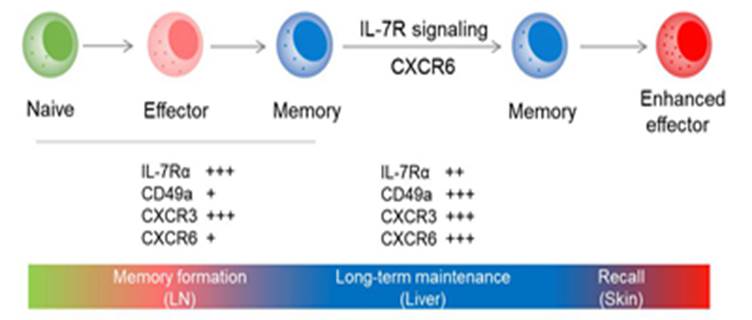
7、揭示记忆性ILC1s形成及维持机制(Nature Communications,2018,9: 4854 )
2018年11月19日,自然出版集团旗下《Nature Communications》杂志在线发表了本室田志刚、孙汭教授课题组的研究论文“Memory formation and long-term maintenance of IL-7Rα+ ILC1s via a lymph node-liver axis”,该研究发现ILC1s具有免疫记忆功能,并揭示了其记忆形成及维持机制。
固有淋巴细胞(innate lymphoid cells,ILCs)是固有免疫系统的重要组成部分,在机体抵抗病毒、细菌、寄生虫等病原体感染的免疫应答早期起到关键作用。近年来,越来越多的证据表明ILCs也具有适应性免疫系统的功能-免疫记忆,它们能够对半抗原、MCMV病毒、细胞因子刺激等产生记忆,介导长期的适应性免疫应答。2013年,田志刚教授课题组在国际上首次发现了CD49a+肝脏驻留NK细胞(liver-resident NK, LrNK),并揭示了LrNK细胞的免疫记忆功能(J Clin Invest123, 1444-1456 (2013),之后该细胞被免疫学界列为三大类ILC细胞之一的ILC1。然而,LrNK或ILC1细胞如何应答特异性抗原及如何获得免疫记忆功能仍是未解之谜。
利用接触性超敏反应模型,课题组发现半抗原致敏能够将IL-7Rα+ ILC1s招募至皮肤引流淋巴结,该过程依赖趋化因子受体CXCR3。进入引流淋巴结后,ILC1s迅速应答半抗原,分泌大量IFN-γ和TNF,表现出活化的状态。致敏后48小时,淋巴结ILC1s数量达到峰值;72小时,淋巴结ILC1s获得对特定半抗原的免疫记忆潜能。随后,记忆性ILC1s依赖S1PR1迁出引流淋巴结;通过其表面的CXCR6与肝窦中丰富的CXCL16相互作用,记忆性ILC1s得以驻留在肝脏中。此外,肝窦中的IL-7对于记忆性ILC1s的长期存活具有重要作用。当机体再次遭遇特定抗原时,肝脏驻留的记忆性IL-7Rα+ ILC1s能够迁移到效应部位,介导皮肤局部的炎症反应。综上,该研究鉴定了一群具有免疫记忆功能的ILC1s亚群,记忆性ILC1s在淋巴结中形成,而在肝脏中长期驻留。这项工作对于“ILC Memory”这一新兴领域的研究提供了新的视角。
8、发现FANCM突变导致人无精子症(Genet Med, 2018)
史庆华研究组对一个巴基斯坦近亲结婚后代发生男性不育的家系进行外显子测序分析后筛选到了范可尼贫血(Fanconi Anemia, FA)核心复合物成分FANCM的一个移码突变(c.1946_1958del,p.P648Lfs*16),该移码突变可导致截短蛋白形成。通过制备携带与患者几乎一致的Fancm突变(Fancm∆C/∆C)小鼠分析发现,纯合突变小鼠与患者表型类似,即:精子发生障碍、生育力大幅降低,具体表现为精子数目显著减少、运动能力降低,各级生精细胞大量丢失和圆形精细胞停滞。进一步分析发现:Fancm∆C/∆C小鼠的精原细胞对MMC敏感性增强、增殖受损和圆形精细胞DNA损伤修复缺陷,但减数分裂前期进程未受影响。综上,我们第一次发现FANCM纯合突变导致生精障碍,引起男性不育,但不引起骨髓造血功能衰竭;提供了FANCM纯合突变导致非典型FA的直接证据,为男性不育及FA的诊断和遗传咨询提供指导。
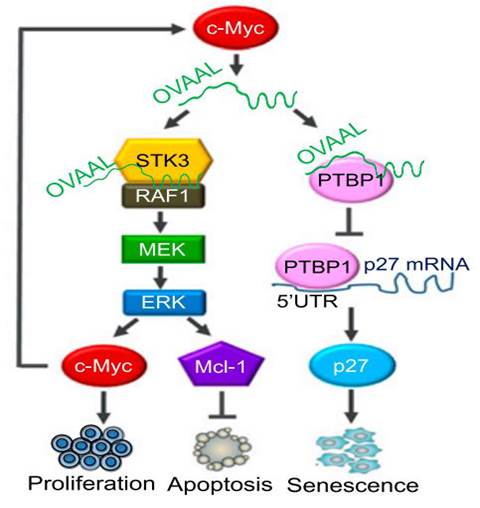
9、 发现OVAAL启动RAF/MEK/ERK促生存信号和逃避p27介导的细胞衰老的双重功能(Proc Natl Acad Sci USA., 2018 Nov 26. pii: 201805950)
长非编码RNA(lncRNA)作为近年来研究的热点分子,其发挥功能的机制很多仍然不清楚。吴缅课题组利用TNF相关的凋亡诱导配体(TRAIL)和Mcl-1抑制剂UMI-77筛选出耐药细胞株,通过高通量测序分析我们发现了在耐药细胞株中高表达的lncRNA—OVAAL,之后的功能研究表明OVAAL与丝氨酸/苏氨酸—蛋白激酶3(STK3)结合从而增强了STK3和Raf-1之间的相互作用并激活下游的ERK信号通路,因此促进了c-Myc介导的细胞增殖和Mcl-1介导细胞抗凋亡功能。另一方面,OVAAL竞争性的与PTBP1结合,抑制了p27分子的表达从而延缓肿瘤细胞的衰老。这些结果揭示了OVAAL通过调控RAF / MEK / ERK信号及p27介导的细胞衰老的双重作用来发挥促进肿瘤细胞的存活和抗凋亡的功能。人为干预降低OVAAL的表达后,肿瘤细胞对于多种抗肿瘤药物的耐药性显著降低,小鼠中移植瘤的生长被抑制,并且会引起细胞衰老。这意味着OVAAL具有潜在的抑癌效应,可能成为癌症临床药物治疗的潜在靶标。
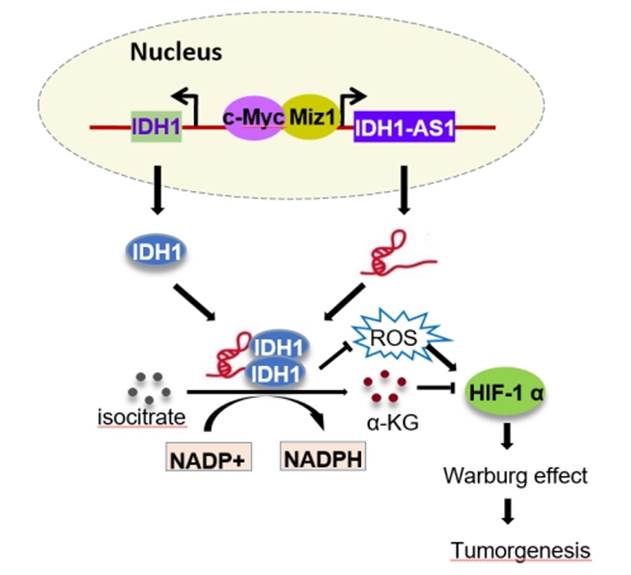
10、发现长非编码RNA调控肿瘤细胞瓦博格效应(Proc Natl Acad Sci USA.2018 Jan 29. pii: 201711257)
癌基因c-Myc是常氧条件下调控糖酵解的主要因子,在肿瘤细胞中的作用尤为显著;而低氧诱导因子HIF1α通常是在低氧条件下才能被诱导表达用以调控糖酵解。但有不少研究发现,即便是在常氧条件下HIF1α也有着较高的表达水平。这两个瓦博格效应的核心调控因子之间有着怎样的联系,到目前仍然没被研究清楚。吴缅课题组发现在常氧条件下,c-Myc通过转录抑制长非编码RNA IDH1-AS1,后者再通过IDH1,调控HIF1α的活性。IDH1-AS1能结合IDH1并促进其二聚化以提高其酶活,而c-Myc转录抑制IDH1-AS1的表达,所以c-Myc通过抑制IDH1-AS1来降低IDH1的活性,从而导致α-KG产量的减少和ROS水平的上升,这两个因素协同稳定HIF1α,使其表达水平升高。通过上面的机制,在常氧条件下c-Myc能够增加HIF1α的表达,从而共同调控瓦博格效应。c-Myc和HIF1α的关键纽带是长非编码RNA IDH1-AS1。进一步的实验表明:IDH1-AS1能够抑制细胞的增殖和裸鼠成瘤能力,这意味着IDH1-AS1具有潜在的抑癌效应,可能会成为一个有潜力的肿瘤代谢治疗靶点。