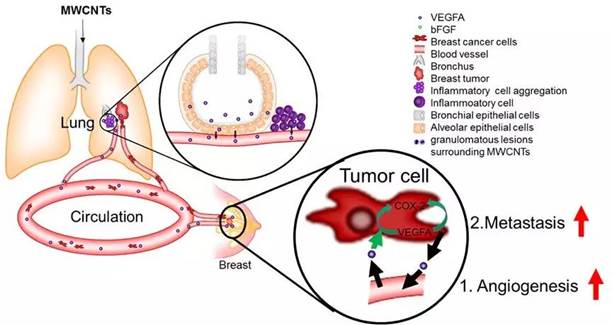
1、碳纳米管呼吸暴露后的延迟毒性导致小鼠原位乳腺肿瘤的多发性广泛转移(Nat Nanotechnol. 2019 Jul;14(7):719-727)
中国科学技术大学朱涛教授团队和国家纳米科学中心陈春英团队合作,在《Nature Nanotechnology》上发表论文“Long-term pulmonary exposure to multi-walled carbon nanotubes promotes breast cancer metastatic cascades”,证明了肺部长期暴露于多壁碳纳米管后可显著增强血管生成和原位乳腺癌的侵袭性,进而导致其向肺部和其他器官的转移。其机理在于暴露于多壁碳纳米管后会刺激产生局部和全身性炎症,这有助于形成转移前和转移性小生境。这一研究结果表明,纳米材料诱发的肺部病变会对肿瘤的发生发展产生复杂而长期的影响。
碳纳米管(Carbon nanotube, CNT)是重要的一维纳米明星材料,CNT的相关产品将和人们日常生活密切相关,然而,CNT呼吸暴露多局限于肺部或心血管系统病变,而缺乏对全身系统影响和长期健康效应的研究。朱涛课题组通过大量研究,首次证实了肺部CNT长期暴露对远端部位的乳腺肿瘤转移有明显的促进作用,长期存在的肺部局部炎症可能是乳腺癌进展的主要风险。该研究工作同时开拓了纳米材料呼吸暴露对远端部位肿瘤发生和发展的毒理学研究新领域。系统性地深入研究典型纳米材料长期暴露的生物安全性和毒理学机制,不但让我们意识到对生产场所的职业人群的健康防护迫在眉睫,同时对普通人群暴露的健康效应研究也具有巨大的现实意义。
该研究工作得到了国家自然科学基金、国家科技部、中国科学院的资助。通讯作者为中国科学技术大学朱涛教授和国家纳米中心陈春英研究员,第一作者为中国科学技术大学吕雪菲和朱勇博士。
2、揭示肝脏肿瘤逃脱自然杀伤细胞免疫监视的新机制(Nature Immunology, 2019 Dec;20(12):1656-1667)
2019年10月21日,中国科学技术大学魏海明教授和田志刚教授课题组与安徽医科大学第一附属医院钱叶本主任合作,发现肝癌中浸润的NK细胞线粒体发生断裂,自身其抗肿瘤功能丢失。研究成果以“Mitochondrial fragmentation limits natural killer cell-based tumour immunosurveillance”为题,在线发表于《自然·免疫》(Nature Immunology)杂志,本研究揭示了一种肿瘤免疫逃逸的新机制,为基于NK细胞的肿瘤免疫治疗提供了新思路与新靶标。
该研究利用透射电镜技术,能够清晰看到正常和肿瘤浸润NK细胞线粒体形态有明显区别,正常NK细胞的线粒体表现为管状、体积大,而肿瘤浸润NK细胞线粒体表现为碎片状、体积小。进一步研究其机理,发现肿瘤微环境的低氧状态,是诱导NK细胞线粒体断裂的重要原因;低氧能够持续激活肿瘤微环境NK细胞的mTOR-Drp1信号,导致线粒体过度分裂,引起NK细胞活性降低和杀瘤能力减弱。在肝癌人群中,肿瘤局部低氧现象越严重的病人,肿瘤组织NK浸润的细胞数量也越少,偏向于“冷”肿瘤,病人术后生存期也更差。使用mTOR或Drp1抑制剂预处理,肿瘤微环境中NK细胞线粒体形态与呼吸效应都能得到明显改善,杀瘤能力也显著增强。该研究从代谢角度诠释了肿瘤来源NK细胞功能絮乱和免疫逃逸的新机制,也为提高NK细胞的免疫治疗提供新策略。
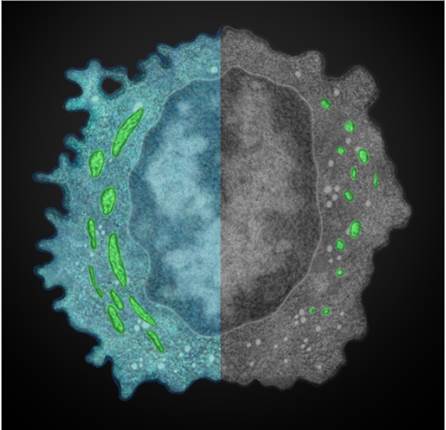
图1:正常NK细胞线粒体呈现管状(左半球,绿色)而肿瘤浸润NK细胞线粒体呈现碎片状(右半球,绿色),(郑小虎提供电镜照片;王国燕、陈磊艺术化)
该研究获国家自然科学基金和中国科学院等经费支持。中国科学技术大学生命科学与医学部、中科院天然免疫与慢性疾病重点实验室和合肥微尺度物质科学国家研究中心郑小虎副研究员为第一作者,魏海明教授与田志刚教授为本文通讯作者,安徽医科大学第一附属医院普外科钱叶本主任等参与研究工作。
3、揭示肠道共生病毒维持肠道粘膜免疫稳态的作用和机制(Nature Immunology 20, 1681–1691(2019))
2019年10月21日,周荣斌/江维/朱书教授课题组合作在Nature Immunology发表题为“Commensal viruses maintain intestinalintraepithelial lymphocytes via noncanonical RIG-I signaling”的研究论文。该研究率先发现在生理情况下,肠道共生病毒对维持肠道上皮内淋巴细胞(IELs)的稳态发挥重要作用,并揭示了其发挥作用的细胞和分子机制。
人体肠道、肺部、皮肤等组织存在大量的共生微生物,包括细菌、病毒和真菌等。近年来大量的研究表明这些共生微生物已经成为人体的一部分,在许多正常生理功能和几乎所有疾病的发生中发挥重要作用。但是,过去几乎所有的研究集中于共生细菌,而对于共生病毒的病理、生理功能研究还非常缺乏。
肠道上皮内淋巴细胞(IEL)作为肠道粘膜免疫的第一道防线,对维持肠道粘膜平衡有着重要作用。该项工作发现共生病毒对于维持肠道上皮内淋巴细胞的稳态发挥重要作用,减少共生病毒会导致肠道上皮内淋巴细胞显著减少。进一步的机制研究发现共生病毒产生的RNA可被肠道固有层内的抗原呈递细胞表达的固有免疫受体RIG-I识别,并进一步通过诱导抗原呈递细胞产生IL-15从而维持肠道上皮内淋巴细胞存活和增殖。最后,该项工作还发现肠道共生病毒对上皮内淋巴细胞稳态的维持有助于抑制肠道组织损伤和炎症发生。该项研究率先揭示了肠道共生病毒在肠道免疫稳态维持中的作用,并阐明了机制,提示肠道共生病毒失衡可能在肠炎、肠癌等疾病中发挥重要作用。
4、环形RNA调控细胞代谢研究中取得新进展(Cell Metabolism. 2019; 30 (1): 157-173.e7)
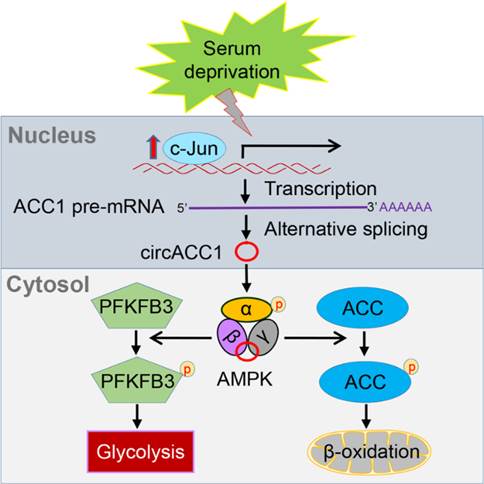
5月30日,吴缅教授研究组在国际著名学术期刊Cell Metabolism上在线发表题为“CircACC1 Regulates Assembly and Activation of AMPK Complex under Metabolic Stress”的研究论文。
肿瘤细胞的代谢异常是肿瘤的重要特征之一,AMPK作为细胞中重要的能量感受器,监控整个细胞的能量代谢水平并调控细胞的合成与分解代谢。当细胞内能量缺乏时,AMPK激活并关闭耗能的合成代谢,与此同时开启产能的分解代谢。AMPK在细胞代谢的调控中处于核心的位置,是机体进行宏观调控的重要工具,其本身的活性也受到严格的调控。目前已知的AMPK上游激酶有LKB1、CaMKK2和TAK1,除此之外一些小分子如AICAR、A-769662等也可以激活AMPK。近年来,非编码RNA作为一个新兴的功能性分子,越来越引起人们的重视,长链非编码RNA参与调控AMPK已有报道,但是环形RNA是否参与调控AMPK却未被发现。ACC1 (乙酰辅酶A羧化酶,ACACA)是脂肪酸从头合成中反应中第一步的关键酶。吴缅教授研究组发现:血清饥饿条件会激活JNK-c-JUN,而转录因子c-JUN的激活使得ACC1基因更多表达环状RNA分子CircACC1而非线性ACC1 mRNA。CircACC1通过结合AMPK的β1和γ1调节亚基,进而稳定并激活AMPK复合物。AMPK的激活促进细胞中的脂肪酸β氧化和糖酵解。此外,在结直肠癌临床病例中,CircACC1的表达与AMPK的激活呈现正相关。因此,该研究发现了从营养缺乏下的一条JNK-c-JUN-circACC1-AMPK 细胞存活通路。通过这一信号通路,丰富了我们对环形RNA参与细胞代谢调控的认识。
该研究得到了基金委、科技部和中科院的基金资助。吴缅教授和胡汪来副教授是本文的共同通讯作者。
5、揭示肝脏驻留NK细胞免疫负调功能(Immunity. 2019 Feb 19;50(2):403-417 )
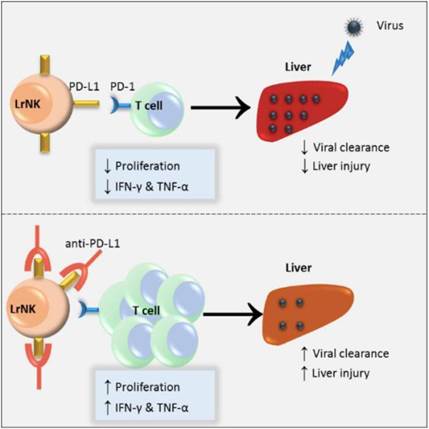
2019年2月19日,Cell出版集团旗下免疫学顶级期刊《Immunity》刊登了中国科学技术大学生命科学与医学部、中科院天然免疫与慢性疾病重点实验室和合肥微尺度物质科学国家研究中心田志刚院士课题组的研究论文“Liver-resident NK cells control antiviral activity of hepatic T cells via PD-1/PD-L1 axis”,该研究发现肝脏驻留NK细胞能负调T细胞的抗病毒免疫应答及其机制。
课题组利用LrNK细胞缺陷小鼠进行实验,发现对该缺陷小鼠进行病毒感染后,小鼠肝脏中T细胞功能增强,病毒滴度减少。对正常小鼠或LrNK细胞缺陷小鼠外源转输LrNK细胞则可以抑制肝脏中抗病毒T细胞应答,cNK细胞则对T细胞应答具有促进作用。体内外实验进一步发现,LrNK细胞依赖于其表面的PD-L1发挥对肝脏中T细胞的功能抑制。该文章系统阐述了LrNK与cNK细胞在调控T细胞应答的完全相反的功能,提示LrNK细胞在肝脏免疫耐受微环境的维持中扮演着重要作用。这项工作对于理解NK细胞亚群组成与区域免疫特性塑造之间的内在联系提供了新依据。
该研究工作得到了国家自然科学基金委和中科院的资助。通讯作者为中国科学技术大学田志刚教授与彭慧副教授,第一作者为中国科学技术大周静博士。
6、秀丽线虫中lincRNA的功能研究(Genome Biology, 2019; 20:7)
单革教授课题组在Genome Biology发表了题为《Systematic evaluation of C. elegans lincRNAs with CRISPR knockout mutants》的文章。单革教授实验室在2017年发表的Developmental Cell文章基础上的深入研究,通过优化的CRISPR-cas9 系统对秀丽线虫中155个基因间的长链非编码RNA(lincRNA)进行逐一敲除(秀丽线虫已知的全部lincRNA共170个),系统地研究了秀丽线虫中lincRNA的功能。这也是第一篇在多细胞动物中利用CRISPR-cas9技术、在全基因组水平上、对一种特定类型长非编码RNA进行敲除并系统分析其生理功能及功能机理的研究。对155个lincRNA敲除突变体进行六个方面表型的筛选发现23个lincRNA突变体分别在其中一个或者两个生理表型上具有不同程度的缺陷。通过对秀丽线虫不同发育时期的转录组测序进行分析,作者研究了lincRNA 和mRNA共表达情况,同时建立了lincRNA和microRNA共表达及调控网络。通过对秀丽线虫不同发育时期近300个转录因子的ChIP-seq分析来探究转录因子在线虫不同发育阶段对lincRNA的调控,进而研究了这23个lincRNA行使其生理调控功能的机理。本研究系统地探索了lincRNA在多细胞动物中的生理功能,一定程度拓宽了lincRNA研究领域,同时该研究获得的lincRNA敲除线虫株为后续进一步研究长链非编码RNA在衰老和疾病等中的作用提供了有力支持。
该研究得到了科技部、国家基金委、以及中科院“衰老的生物学基础和干预策略”先导科技专项(培育)的经费支持。通讯作者为中国科学技术大学单革教授,第一作者为中国科学技术大学博士生卫帅,博士后陈禾及2018年博士毕业生Emmanuel Enoch Dzakah。
7、PIRCh-seq 研究非编码 RNA 和染色质结合的功能与机制(Genome Biology,2019)
瞿昆课题组同斯坦福大学医学院Howard Chang课题组合作开发了名为PIRCh-seq (Profiling Interacting RNAs on Chromatin)的测序技术。该技术可利用不同组蛋白抗体或组蛋白修饰抗体,如H3、H3K4me3、H3K27ac等,富集结合在对应区域上的非编码RNA,之后利用高通量测序技术,实现在组蛋白修饰这一表观基因组水平,定性并定量的分析和染色质结合的非编码RNA。利用PIRCh-seq,我们一方面可以筛选到细胞内和染色质,尤其是不同修饰状态下的染色质结合的非编码RNA,系统性的描述非编码RNA和染色质的结合特征,另一方面通过开发新的生物信息学算法和模型,深入研究和染色质结合的非编码RNA的功能及其对基因转录调控的作用机制。该研究也进一步证实了PIRCh-seq所发现的染色质结合非编码RNA的确具有潜在的生物学功能,利用 ChIRP-seq和组蛋白修饰ChIP-seq检测发现实验结果与PIRCh-seq的结果高度一致。同时对ChIRP-seq发现的lnc-Nr2f1结合位点功能分析发现lnc-Nr2f1具有调控神经细胞发育的能力,这也和我们最近发表的关于lnc-Nr2f1的功能研究结果符合。
该技术对系统性的揭示非编码RNA和染色质的互作机理有重要的科学意义,并为进一步研究非编码RNA对基因转录的调控机制提供了新的方法和手段,将有可能在非编码RNA研究领域有广泛的应用前景。
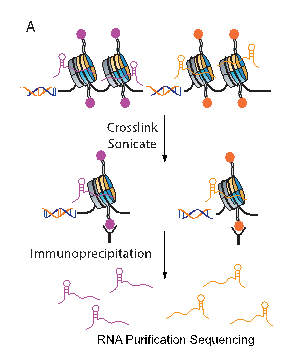
PIRCh-seq试验示意图
该研究工作得到了国家自然科学基金、国家科技部、中国科学院的资助。通讯作者为中国科学技术大学瞿昆教授和斯坦福大学医学院Howard Chang教授,第一作者为中国科学技术大学方靖文博士和斯坦福大学医学院马晴博士。
8、利用纳米级联簇化酶用于无系统毒性的肿瘤葡萄糖耗竭治疗(ACS Nano, 2019, 13,8890-8902)
7月10日,美国化学学会旗下《ACS Nano》杂志在线发表了王育才教授课题组的研究论文“Nano-Clustered Cascaded Enzymes for Targeted Tumor Starvation and Deoxygenation-Activated Chemotherapy without Systemic Toxicity”,该研究成功展示了一种通过结合靶向肿瘤饥饿和脱氧激活化疗来强化癌症治疗的级联催化纳米药物的方法。这一策略提供了一个创新的肿瘤饥饿和脱氧激活化疗的协同治疗设计方式,从而提高抑制肿瘤效果。
肿瘤内葡萄糖耗竭诱导的癌症饥饿疗法(tumor starvation)代表了抗癌治疗的重要策略,但它通常受到全身毒性,非特异性和平行能量供应的适应性发展的限制。因此,必须将智能材料设计概念结合到治疗模式中,从而能够有效地消除肿瘤内葡萄糖,具有高特异性和低毒性,用于癌症饥饿治疗。
课题组通过长期努力,研究出一种BSA包被的纳米级联簇化酶(BCETPZ@(GOx+CAT))在循环过程中保持稳定,不会引起全身毒性,并且能够在轻度酸性肿瘤微环境中释放GOx和CAT,消耗肿瘤部位葡萄糖同时造成乏氧环境激活乏氧前药,从而实现低毒性肿瘤饥饿并产生局部缺氧以激活化学疗法的协同治疗。(1)白蛋白外壳在循环过程中可以防止酶快速,过早地暴露在血液中;(2)在肿瘤酸性微环境中选择性释放级联酶;(3)GOx消耗肿瘤部位氧气(O2)并造成缺氧环境,产生H2O2和葡萄糖酸,而CAT将产生的H2O2转化为H2O而不会引起全身毒性;(4)步骤3中产生的葡萄糖酸进一步加速纳米簇酶的降解;(5)在缺氧环境中通过还原酶活化乏氧前药BSATPZ,协同葡萄糖消耗肿瘤饥饿疗法。之后检测了纳米簇化酶在肿瘤内消耗氧的能力。纳米簇化酶静脉注射样品后24小时内,纳米簇化酶可以迅速消耗肿瘤中的O2,并且检测48h仍拥有持续消耗葡萄糖和氧气的能力。综上,纳米药物在血液循环过程中保持稳定并仅在肿瘤微酸环境释放原酶快速耗尽肿瘤细胞中的葡萄糖和O2,实现低毒性的肿瘤的饥饿疗法,并产生局部缺氧来激活化疗。
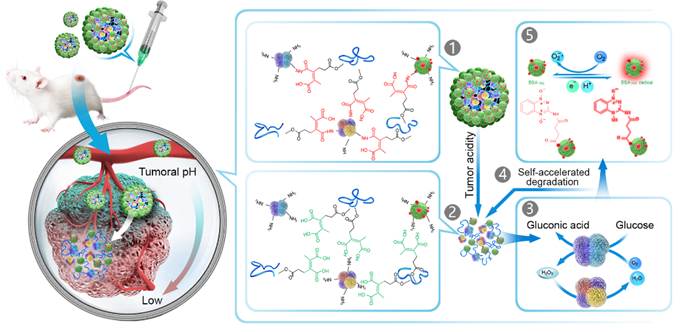
该研究工作得到了国家自然科学基金、国家科技部。通讯作者为中国科学技术大学王育才教授,第一作者为中国科学技术大学马寅初,赵阳阳和纳文博士。
9、iRGD肽修饰的红细胞膜包被的氧化石墨炔纳米片能在肿瘤组织原位产氧和增强血液灌注缓解乏氧,从而增强肿瘤光动力学治疗。(Nano letters, 2019, 19, 4060-4067)
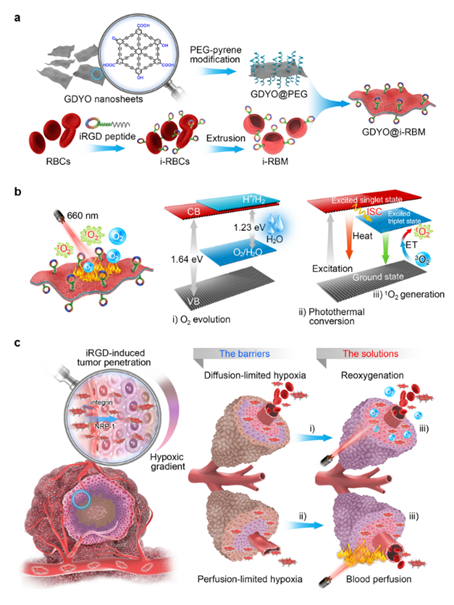
5月28日,ACS出版集团旗下《Nano Letters》杂志在线发表了王育才教授课题组的研究论文“Tumor Reoxygenation and Blood Perfusion Enhanced Photodynamic Therapy using Ultrathin Graphdiyne Oxide Nanosheets”,该项研究成果上发展了一种iRGD肽修饰的红细胞膜包被的氧化石墨炔纳米片,其能通过在肿瘤组织原位产氧和增强血液灌注同时克服两种类型的乏氧,从而显著提高肿瘤光动力治疗的效果。
肿瘤微环境同时存在血液灌注限制的急性乏氧(perfusion-limited acute hypoxi)和氧气弥散距离限制的慢性乏氧(diffusion-limited chronic hypoxia)。二者对于光动力学治疗(PDT)的效果均具有明显的抑制作用。研究者们通常应用载氧材料(O2-carrying materials)、光催化产氧材料及微光热治疗单一改善扩散型或者灌注型乏氧,以提高肿瘤治疗效果。迄今为止,可以同时改善灌注型乏氧和扩散型乏氧的材料与应用研究尚未被报道。
一种iRGD肽修饰的红细胞膜(i-RBM)包被的氧化石墨炔(GDYO)纳米片(GDYO@i-RBM),其能通过在肿瘤组织原位产氧和增强血液灌注同时克服两种类型的乏氧,从而显著提高PDT治疗的效果。研究者首先通过强酸氧化与液相超声剥离成功制备尺寸120 ± 15 nm,厚度~1.7 nm的GDYO纳米片。研究发现,氧化与剥离成功调控了石墨炔(GDY)的能带结构,明显降低的价带端(VBM)赋予GDYO更高的光氧化热力学驱动力,结合GDYO强的光吸收能力以及超薄的二维结构,从而表现出超高的光催化活性。在近红外光照射下,GDYO纳米片同时表现出优异的催化水分解产氧、单线态氧以及光热转换性能。为了提高GDYO纳米片的肿瘤靶向性能力以及生物相容性,该团队利用iRGD肽修饰的红细胞膜(i-RBM)包被GDYO纳米片,获得仿生纳米片GDYO@i-RBM。肿瘤组织在注射GDYO@i-RBM纳米片并经近红外光照后,肿瘤血管出现明显的扩张现象,扩张血管周边的乏氧信号(绿色荧光)也随之明显减弱,这是由于i-RBM包被赋予GDYO纳米片良好的肿瘤富集及其优异的光催化产氧缓解了肿瘤扩散型乏氧;与此同时,GDYO的光热转化功能,能够有效扩张肿瘤血管,增强血液灌注,从而有效克服了灌注型的乏氧。因此,本工作以仿生结构的GDYO纳米片为平台,通过同时改善扩散型乏氧与灌注型乏氧,显著提高肿瘤PDT治疗效果。
该研究以二维共轭微孔聚合物为平台,通过能带结构调控、仿生修饰同时提升其光催化水分解产氧活性以及靶向能力,并成功应用于缓解肿瘤乏氧;也为今后设计和合成共轭微孔聚合物纳米载体应用于缓解扩散和灌注限制的肿瘤乏氧提供了新的启发。
该工作得到了国家自然科学基金,国家重点研发计划的资助。本文的共同通讯作者为徐航勋教授与王育才教授。本论文共同第一作者为博士生蒋为、张震与汪沁同学。
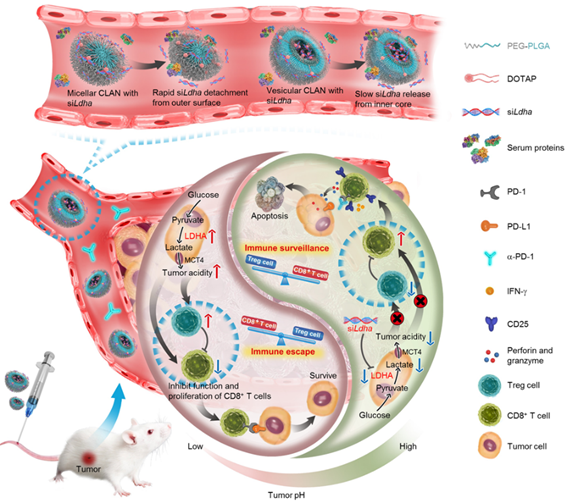
10、高分子纳米药物调控肿瘤酸性微环境及免疫微环境(Nano Letters, 2019, 19, 5, 2774-2783)
近日,王育才教授课题组在Nano Letters上发表了研究论文“Nano-Enabled Modulation of Acidic Tumor Microenvironment Reverses Anergy of Infiltrating T Cells and Potentiates Anti-PD-1 Therapy”,该研究首次提出利用高分子纳米药物逆转肿瘤酸性微环境和免疫耐受,进而增强检查点抑制剂α-PD-1的免疫治疗效果。
在肿瘤的发展过程中,快速增殖的肿瘤细胞会分泌大量的乳酸导致肿瘤微环境呈酸性。肿瘤酸性微环境会通过多种机制导致肿瘤浸润的T细胞失能,进而导致免疫检查点抑制等基于T细胞的免疫疗法失效。因此,调控肿瘤酸性微环境是提高肿瘤免疫疗法潜在的有效策略。
基于上述,课题组从肿瘤酸性微环境的产生机制入手,首次利用基于高分子纳米药物的体内RNA干扰技术,在肿瘤中敲低在乳酸生成过程起关键作用的乳酸脱氢酶(LDHA),抑制乳酸的的分泌,从而逆转肿瘤的酸性微环境。
王育才教授课题组及其合作者此前发明了胶束型(MNP)和囊泡型(VNP)的阳离子辅助的纳米颗粒用于核酸药物的系统递送,两种颗粒组分均为PEG-PLGA嵌段共聚物和阳离子脂质,但组装体结构不同。进一步的研究发现VNPsiLdha在乳腺癌和黑色素瘤两种肿瘤模型中均可有效降低LDHA表达和抑制乳酸分泌,进而降低肿瘤酸度。VNPsiLdha显著增加了肿瘤中CD8+ T细胞和NK细胞的浸润,同时降低了免疫抑制性Treg细胞的浸润,从而明显抑制了肿瘤的生长。此外,免疫检查点抑制剂α-PD-1也在酸度中和后的肿瘤中显示出了更好的治疗效果。同时在免疫缺陷的B6/Rag1-/-和NOG小鼠身上进行了相同的治疗,发现尽管VNPsiLdha仍可以敲低LDHA的表达以及抑制乳酸的分泌,但肿瘤生长并没有被抑制。这一结果进一步说明逆转肿瘤酸性微环境是通过改善肿瘤免疫抑制肿瘤生长的。
该研究工作得到了国家重点研发项目“纳米科技”重点专项(2017YFA0205600)和国家自然科学基金(51773191, 51573176和51633008)的资助。该论文的通讯作者为中国科学技术大学生命科学学院的王育才教授,第一作者为博士生张钰雪和赵阳阳以及硕士生申纪周。
11、揭示HBV慢性感染导致肝癌发生的机制(Nature Communications,2019 Feb 26;12(570) )
1月15日,自然出版集团旗下《Nature Communications》杂志在线发表了中国科学技术大学生命科学与医学部、中科院天然免疫与慢性疾病重点实验室、合肥微尺度物质科学国家研究中心田志刚院士课题组的研究论文“Breakdown of adaptive immunotolerance induces hepatocellular carcinoma in HBsAg-tg mice”。该研究在转基因小鼠中发现TIGIT抑制性通路维持了CD8+T细胞对HBV的耐受,而打破这种耐受可以使HBV转基因小鼠(HBV携带模型)肝脏产成慢性炎症,最终发展成肝癌。
该研究发现HBV转基因(HBs-tg)小鼠肝脏高表达抑制性受体TIGIT, 通过持续性阻断TIGIT抑制性通路,可以使小鼠产生慢性肝炎。对TIGIT阻断后的小鼠进行HBV表面抗原疫苗免疫,小鼠可以产生肝癌。对机制进行探索,研究人员发现TIGIT阻断后HBs-tg小鼠肝脏中CD8+T细胞数目增多,活化增强,并出现抗原特异性CTLs。清除CD8+T细胞的HBs-tg小鼠阻断TIGIT后肝损伤明显减轻;若对TIGIT阻断后的HBs-tg小鼠在疫苗免疫期间清除CD8+T细胞,则不会发展成为肝癌。综上所述,该研究发现TIGIT抑制性通路维持了HBV携带鼠中CD8+ T细胞的耐受,并且成功建立了一个由慢性HBV感染导致的肝癌小鼠模型,为后续深入研究HBV相关肝癌的预防和治疗提供了合适的动物平台。

图:HBV转基因小鼠TIGIT阻断后产生慢性肝炎
该研究工作得到了国家重点研发计划、国家自然科学基金、中科院先导项目和重大专项的资助。通讯作者为中国科学技术大学田志刚院士,第一作者为中国科学技术大学宗璐博士。
12、长非编码RNA调控炎症小体组装激活中取得新进展(Nature Communications,2019,10(1):1495)
4月3日,吴缅教授研究组在国际学术期刊Nature Communications上在线发表题为“The lncRNA Neat1 promotes activation of inflammasomes in macrophages”的研究论文。
在固有免疫反应中,巨噬细胞通过协调炎症反应发挥重要的功能。炎症小体是由胞浆内模式识别受体(PRRs)参与组装的多蛋白复合物,是炎症反应的关键效应器。炎症小体能够识别病原相关分子模式(PAMPs)或宿主来源的危险信号分子(DAMPs),招募和激活促炎症蛋白酶caspase-1。而活化的caspase-1切割IL-1β和IL-18的前体, 产生相应的成熟细胞因子。炎症小体的活化还能够诱导细胞的炎症坏死,即焦亡(pyroptosis)。炎症小体活化与多种人类重大疾病的发生有着密切的关系。目前已发现的炎症小体主要有NLRP1、NLRP3、NLRC4和AIM等。但是关于炎症小体组装以及其中的调控机制的了解还不是很清晰。长非编码RNA(lncRNA)作为生命科学领域研究的热点分子,在参与调控炎症小体激活的研究中鲜有报道。
吴缅教授研究组发现受低氧诱导因子HIF-2α转录激活的lncRNA Neat1可以直接参与炎症小体的组装和激活,Neat1通过其5’端与caspase-1 p20亚基直接结合,既可以结合在pro-caspase-1上稳定炎症小体复合物的组装,也可以结合在成熟的caspase-1四聚体上增加其稳定性和酶活性。在巨噬细胞中,Neat1通过以上途径促进炎症小体的组装激活,增加成熟caspase-1四聚体的形成,从而上调促炎因子IL-1β和IL-18的成熟和分泌,并促进细胞焦亡。此外,在相关药物的诱导下,Neat1基因敲除小鼠较野生型小鼠表现出更低水平的腹膜炎和肺炎,进一步从体内证明了Neat1具有促进炎症反应的功能。
该研究得到了基金委、科技部和中科院的基金资助。美国宾夕法尼亚大学杨小鲁教授是本文的共同通讯作者,吴缅教授研究组的博士研究生张鹏飞和曹利勉为该论文的共同第一作者。中国科学技术大学周荣斌教授在该项目的研究过程中给予了极大的帮助。
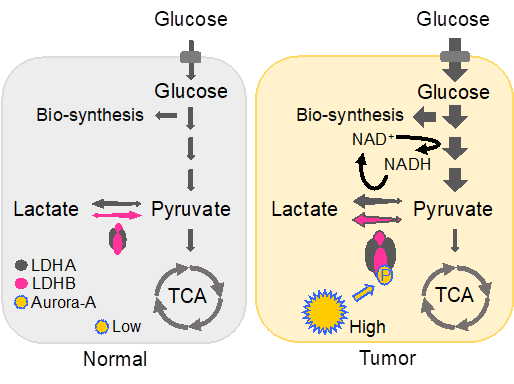
13、细胞周期激酶Aurora-A通过调控乳酸脱氢酶LDHB的磷酸化解除其底物抑制进而调控糖酵解(Nature Communications,2019)
2019年11月,期刊《Nature Communications》接收了杨振业课题组的研究论文“Aurora-A Mediated Phosphorylation of LDHB promotes glycolysis and tumor progression by relieving the substrate-inhibition effect”。
代谢重编程是肿瘤细胞的一个重要特征。著名科学家奥托·瓦博格20世纪20年代就发现即使在氧气充足的条件下,肿瘤细胞仍然会进行活跃的糖酵解(Warburg effect)。背后的分子机制通常认为是通过高表达葡萄糖转运蛋白(GLUT)以及乳酸脱氢酶A(LDHA)等来实现的,但是在很多肿瘤细胞中,和LDHA催化反应相反的代谢酶LDHB也是高表达的,为何肿瘤细胞需要高表达这种逆向反应的酶,而且在高表达这种逆向反应酶的同时还能进行快速的糖酵解,这个“矛盾”一直没有合理的解释。
杨振业课题组发现一种在肿瘤细胞中高表达的蛋白激酶Aurora-A可以直接结合并且磷酸化LDHB上162位的丝氨酸,这种磷酸化的修饰可以通过解除底物丙酮酸对其抑制作用,逆转LDHB催化反应倾向性,把它变成了增强版的LDHA,从而加速NAD+的回收,促进糖酵解和生物合成,有利于肿瘤细胞的快
速增殖。该研究对临床上部分肿瘤的靶向治疗具有潜在的指导意义。
论文的共同第一作者为中国科学技术大学生医部博士后程傲星、博士生张鹏、军事医学科学院王勃副研究员和中国科学技术大学博士后杨冬冬。该研究在国家自然科学基金委、科技部以及中科院的资助下完成。
14、发现DNAH17错义突变导致精子尾部结构不稳定及弱精子症(Journal of Experimental Medicine, 2019)
10月28日,The Journal of Experimental Medicine发表了史庆华实验室题为“A DNAH17 missense variant causes flagella destabilization and asthenozoospermia”的论文。他们首次报道了DNAH17纯合错义突变特异引发4-7号微管二联体不稳定(图1-B),并导致弱精子症。根据WHO标准,弱精子症是指精液中前向运动的精子少于32%,约占男性不育患者的19%,但弱精子症致病原因多不清楚。史庆华课题组通过对弱精子症家系遗传筛查和动物模型的功能验证,发现DNAH17的纯合错义突变可特异性地导致精子尾部4-7号二联体微管的缺失,而且缺失比例是由精子在附睾中储存的时间决定的。该发现首次揭示动力臂蛋白对维持精子尾部结构稳定是必需的,也提示精子尾部9组微管二联体的组成和性质不同,提示这类患者有可能通过指导生育(缩短禁欲时间)而达到自然生育目的,也可为WHO相关指南的修订提供参考。
该研究工作得到了中国国家重点研发计划、国家自然科学基金、中央大学基础研究基金等支持。通讯作者为中国科学技术大学史庆华教授、马慧副研究员和张远伟副研究员,第一作者为中国科学技术大学张贝贝和马慧博士。

15、发现调节表皮稳态的新型长链非编码RNA分子PRANCR(Genome Research)
《Genome Research》杂志接受了瞿昆教授课题组的研究论文“A genome-wide long noncoding RNA CRISPRi screen identifies PRANCR as a novel regulator of epidermal homeostasis”,该项研究成果揭示了PRANCR这一新型长链非编码RNA可以调节角化细胞增殖,细胞周期进程和克隆形成能力,同时缺失该基因会导致表皮分层受损,为表皮稳态提供生物学过程基础。全基因组关联研究表明:许多疾病易感性区域位于基因组的非蛋白质编码区域。长链非编码RNA是非编码基因组的主要组成部分,但其生物学影响尚不完全清楚。迄今为止,已经编入了近28,000个人类长链非编码RNA,但在功能上仅鉴定了约200个。在表皮中,祖细胞增殖和分化之间存在动态,持续的平衡。增殖或分化的遗传上破坏会导致稳态紊乱,并成为湿疹,牛皮癣和角化细胞癌等常见疾病的基础,它们共同影响着超过20%的人口。因此了解长链非编码RNA在表皮稳态中的潜在作用与人类健康有着广泛的联系。
该研究工作得到了中国国家重点研发计划、国家自然科学基金、中央大学基础研究基金, 国家关节炎与肌肉骨骼研究所和美国国立卫生研究院,以及多丽丝·杜克慈善基金会支持。通讯作者为中国科学技术大学瞿昆和UCSD Bryan教授,第一作者为中国科学技术大学蔡鹏飞和UCSD Auke博士。
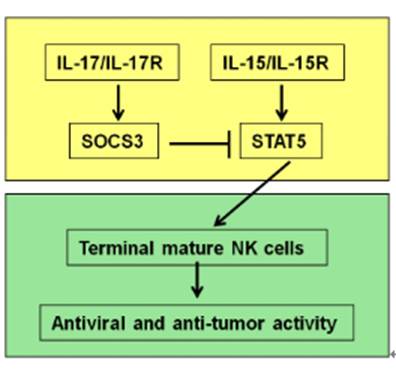
16、揭示NK细胞终末成熟调控新机制(PNAS. 2019 Aug 27;116(35):17409-17418)
2019年8月12日,美国科学院院刊《PNAS》在线发表了中国科学技术大学生命科学与医学部、中科院天然免疫与慢性疾病重点实验室和合肥微尺度物质科学国家研究中心田志刚院士课题组的研究论文“IL-17 constrains natural killer cell activity by restraining IL-15–driven cell maturation via SOCS3”。该研究发现IL-17通过上调SOCS3抑制IL-15驱动的NK细胞成熟,对NK细胞的抗病毒抗肿瘤活性行使负相调控。
该研究发现,IL-17A-/-、IL-17F-/-、IL-17A-/-IL-17F-/-、IL-17RA-/-等IL-17信号缺陷小鼠含有更高比例和数量的终末成熟NK细胞。同时,这些缺陷小鼠表现出更强的抗肿瘤和抗病毒的能力,且此能力依赖于NK细胞。联体实验、骨髓移植实验及骨髓嵌合实验证实,生理水平的IL-17A即可抑制NK细胞的终末成熟,而持续高表达IL-17A则可更加显著地降低体内终末成熟NK细胞的比例和数量。体外和体内共刺激实验显示,IL-17A可抑制IL-15介导NK细胞的存活、成熟和增殖。分子机制研究发现,IL-17A并未下调NK细胞表面的IL-15受体而是抑制了IL-15受体信号通路下游的STAT5磷酸化,且该抑制作用是依赖于IL-17A诱导的SOCS3,抑制SOCS3可以阻断IL-17A对STAT5磷酸化及NK细胞终末成熟的抑制作用。综上所述,该研究发现IL-17A通过上调SOCS3抑制IL-15信号以阻碍NK细胞发育成熟,一方面提示IL-17对于NK细胞的过度活化具有约束效应,以阻止过度免疫应答或维持NK细胞免疫功能的稳态;另一方面也提示阻断IL-17通路,有利于恢复肿瘤或病毒感染时NK细胞的功能不足,有利于基于NK细胞的免疫治疗。该研究揭示了调控NK细胞发育成熟和效应功能的新机制,为基于NK细胞的免疫治疗提供新思路新靶点。
该研究工作得到国家自然科学基金、中科院先导项目和安徽省自然科学基金资助。通讯作者为中国科学技术大学田志刚院士,第一作者为王学富博士。
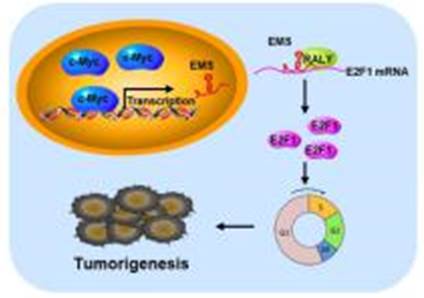
17、揭示长链非编码RNA-EMS能够介导癌蛋白c-Myc的促癌功能(PNAS, 2019 116 (29) 14620-14629;)
2019年7月1日,中国科学技术大学梅一德研究组在国际权威期刊PNAS上发表题为“Long non-coding RNA EMS connects c-Myc to cell cycle controland tumorigenesis”的文章,报道了一种c-Myc诱导的lncRNA,命名为E2F1 mRNA稳定因子(EMS),并提供了c-Myc如何促进肿瘤发生的机制的见解,并提出EMS可能是介导c-Myc致癌功能的重要参与者。
梅一德研究组通过数据库分析和实验验证,鉴定了一个新的在多种类型肿瘤包括肺癌、乳腺癌和肠癌中异常高表达、且具有促癌功能的长链非编码RNA,并将其命名为EMS(E2F1 mRNA stabilizing factor)。EMS作为c-Myc的直接转录靶标,能够介导c-Myc通过控制细胞周期运转促进肿瘤形成的作用。在分子机制层面,EMS通过与RNA结合蛋白RALY相互作用,从而稳定细胞周期关键调控因子E2F1的 mRNA并增强其蛋白表达水平,最终促进G1/S细胞周期运转以及肿瘤细胞的快速增殖。该研究阐明了EMS这一长链非编码RNA能够作为信使分子传递c-Myc的促癌信号,为深入理解c-Myc促进肿瘤形成的分子基础提供了新的视角,并暗示EMS可能作为肿瘤治疗的一个新的潜在靶标。该研究工作发表于PNAS(2019)杂志上。
梅一德研究组的博士研究生王晨峰和杨洋是该论文的共同第一作者。该研究工作还得到了生命学院单革教授研究组以及附属第一医院马筱玲教授和吴显宁博士的大力帮助。该项研究在国家自然科学基金委、科技部和中央高校基本科研业务费的经费资助下完成。
18、染色质可及性分析揭示人胚胎视网膜发育和类器官分化过程的表观调控机制(Science Advances,2019)
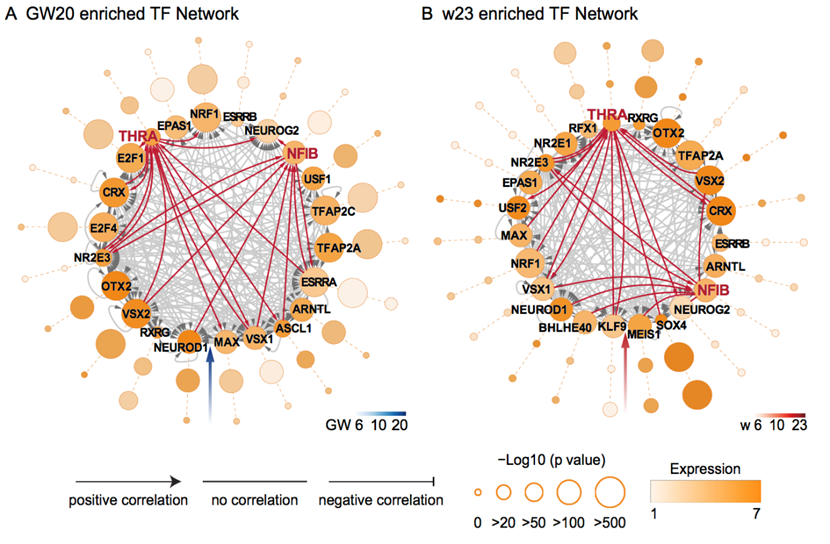
科学出版集团旗下《Science Advances》杂志发表了薛天、瞿昆教授课题组的研究论文“ Chromatin accessibility analysis reveals regulatory dynamics of developing human retina and hiPSC-derived retinal organoids”,该项研究成果系统地揭示了人类视网膜和类器官培养过程中的染色质可及性的动态变化,发现NFIB和THRA参与调控人胚胎视网膜发育并构建了人胚胎视网膜发育的转录调控网络。
视网膜器官(RO)是体外生长的三维视网膜样结构,它提供了一个研究人类视网膜发育和疾病的体系,但是,由于我们对发育中的人类视网膜与RO之间的分子和功能差异的了解有限,阻碍了使用类器官进行临床研究的进展。因此,建立发育中的人类视网膜与类器官之间的表观遗传相关性至关重要。
课题组通过长期努力,收集了从妊娠第6周第 25周的发育过程的人胚胎视网膜样本(GW6、10、11、12、14、15、20、24、25),以及类器官形成过程中第0周到第30周(w0、2、4、6、10、15、23、30)的样本进行ATAC-seq测序。我们绘制了人胚胎视网膜发育和类器官形成过程中染色质可及性的图谱,并揭示了发育阶段中特异性的表观遗传图谱。此外,还重建了调控人胚胎视网膜发育的转录调控网络,并且鉴定了参与人胚胎视网膜发育的转录因子,NFIB和THRA,同时通过类器官的体外基因操作进行了验证。该研究为人胚胎视网膜发育和类器官的形成提供了有价值的数据,并且为优化体外类器官的分化提供了可行的框架。除此之外,我们还发现人与小鼠之间表观遗传调控的差异,这种差异可能有助于基因表达方式和时机的改变,从而在视网膜发育中产生物种差异。因此,这项研究也为了解特定物种的表观基因组调控提供了有价值的信息。
该研究工作得到了国家自然科学基金、国家科技部、中国科学院的资助。通讯作者为中国科学技术大学薛天和瞿昆教授,第一作者为中国科学技术大学谢浩寰和张文博士。
19、乳腺癌中抑制细胞周期激酶Aurora-A的活性可消除髓系来源细胞介导的免疫抑制并增强PD-L1的治疗效果(Cancer Research,2019,Jul 1;79(13):3431-3444)
2019年7月,著名医学期刊《Cancer Research》上发表了杨振业课题组的研究论文“Aurora-A inhibition eliminates myeloid cell mediated immunosuppression and enhances the efficacy of anti-PD-L1 therapy in breast cancer”,该研究成果揭示了在乳腺癌中,抑制细胞周期激酶Aurora-A可促进产生抗肿瘤的免疫微环境,从而抑制肿瘤发展的进程并增强免疫检查点PD-L1的免疫治疗效果。
Aurora-A具有广泛且重要的促癌功能,所以Aurora-A被认为是很有希望的肿瘤治疗靶点。2015年报道的一个二期临床试验中,针对Aurora-A的特异性抑制剂Alisertib在晚期乳腺癌和小细胞肺癌的治疗中得到了较好的结果,是非常有前景的乳腺癌靶向药物。但是Alisertib如何发挥抑癌作用的机制还不是很清楚。
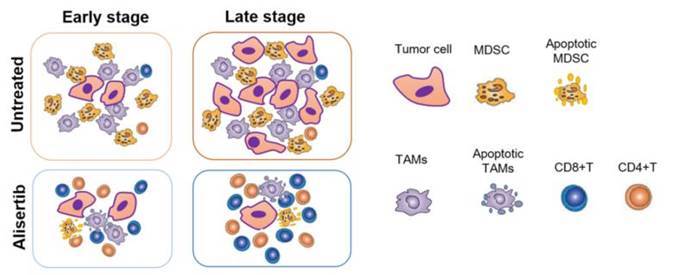
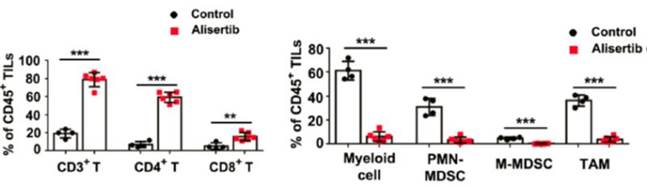
杨振业课题组发现,通过alisertib抑制Aurora-A的活性后,乳腺肿瘤中典型的抑制肿瘤生长的T细胞的绝对数量和比例都有显著增长,而促进肿瘤生长,具有免疫抑制功能的髓系来源细胞MDSC和肿瘤相关巨噬细胞的比例和绝对数目都有显著的下降。进一步的研究发现,抑制Aurora-A的活性可以诱导髓系来源细胞和巨噬细胞的凋亡,并通过抑制Stat3介导的ROS的产生来解除MDSC细胞的免疫抑制功能。更重要的是,alisertib与免疫检查点PD-L1的联合用药可以增强肿瘤的治疗效果。这些研究结果解析了Aurora-A在肿瘤免疫微环境中的重要作用,并为乳腺癌的临床治疗提供新的组合治疗方案。
该研究工作得到了国家自然科学基金、国家科技部、中国科学院的资助。通讯作者为中国科学技术大学杨振业和华南理工大学廉哲雄教授,第一作者为中国科学技术大学尹亭亭博士、赵志斌博士和中国科学技术大学特任副研究员国静。
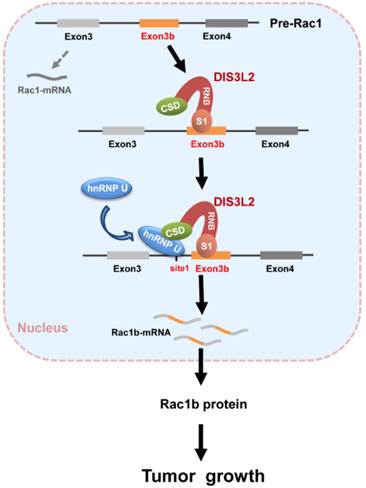
20、揭示Dis3l2在肝癌发生发展中的机制(Cancer Res 2019;79:4923–36)
7月22日,《Cancer Research》杂志在线发表了中国科学技术大学张华凤教授课题组、高平教授课题组联合附属第一医院荚卫东教授课题组在肝癌发生发展相关机制的研究论文“DIS3L2 promotes progression of hepatocellular carcinoma via hnRNP U-mediated alternative splicing” 。该研究发现了DIS3L2在肝癌中异常高表达并且通过hnRNP U介导的选择性剪切来促进肿瘤的发生发展,尤其是在剪切事件中促进了Rac1b的选择性剪切体表达,进而促进肝癌的发生发展。
RNA降解相关蛋白DIS3L2降解异常的RNA,但其在肿瘤发生发展中的作用并未深度探索。该研究发现DIS3L2在肝癌中呈高表达状态,在肝癌细胞中过表达DIS3L2可以明显促进细胞增殖。研究人员进一步发现在肝癌细胞中DIS3L2可以与hnRNP U直接相互作用,DIS3L2通过hnRNP U的介导调控选择性剪切。研究人员更进一步发现DIS3L2与hnRNP U结合后可以共同促进Rac1b的选择性剪切体的表达,从而促进肿瘤的增殖。单独敲低DIS3L2或hnRNP U均可明显抑制Rac1b的表达,抑制肝癌细胞的增殖,回补Rac1B可以明显回复细胞的增殖。
综上所述,该研究揭示了DIS3L2通过hnRNP U调控选择性剪切而促进肿瘤的新机制,对临床肝癌的靶向治疗具有潜在的指导意义。
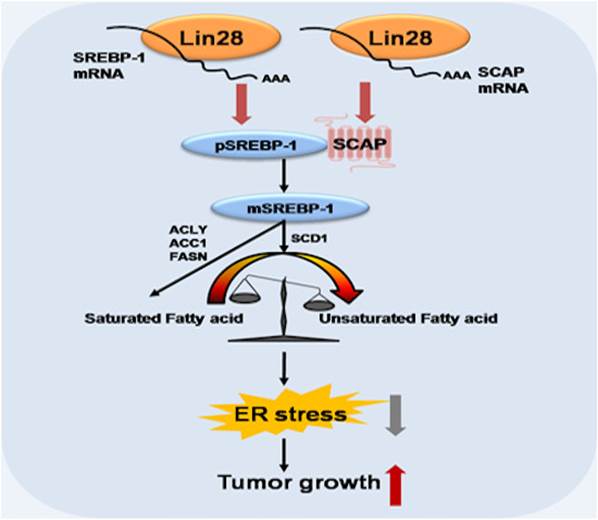
21、揭示肝癌中脂类导致肝癌发生发展的机制(EMBO reports, 2019 Oct 4;20(10):e48115)
张华凤教授课题组、高平教授课题组联合附属第一医院荚卫东教授课题组以及精密仪器系Zachary J Smith教授课题组,在肝癌发生发展相关机制的研究领域取得重要进展,相关成果以“Lin28 enhances de novo fatty acid synthesis to promote cancer progression via SREBP-1”为题,发表在《EMBO Reports》杂志。
肿瘤发生发展的过程十分复杂,肿瘤细胞中,脂肪酸的从头合成代谢明显增强,但是其中的机制并不十分清楚。课题组在前期发现Lin28调节肝癌细胞糖代谢的基础上(Nature Communications 2014),进一步深入的研究表明,Lin28作为重要的RNA结合蛋白,通过调控SREBP-1的翻译及剪切成熟而促进脂肪酸的从头合成过程,更为重要的是可以维持饱和脂肪酸和不饱和脂肪酸的比例处于稳态,进而避免脂毒性的发生,最终有利于肿瘤细胞的存活。该研究揭示了肿瘤代谢中RNA结合蛋白的重要作用和新机制。这项研究对临床肝癌的靶向治疗具有潜在的指导意义。
22、构建NK细胞分化过程中的转录调控网络并发现调控NK细胞分化的关键性转录因子(Genomics, Proteomics & Bioinformatics)
3月4日,《Genomics, Proteomics & Bioinformatics》杂志接收了瞿昆和魏海明教授课题组的研究论文“Landscape and dynamics of the transcriptional regulatory network during natural killer cell differentiation”,该项研究成果构建了NK细胞体外分化过程中的转录调控网络,并发现了调控NK细胞分化的关键性转录因子。天然杀伤(NK)细胞是先天性淋巴细胞,可保护宿主免受感染或癌细胞侵袭。此外,基于NK细胞的免疫疗法已成为癌症治疗中的新兴力量,并将在未来疾病治疗中发挥重要作用,而NK细胞用于免疫治疗依赖于大量具有最佳细胞活性的NK细胞。因此,全面了解NK细胞的分化过程对于提高临床治疗的有效性尤其重要。在这项研究中,我们利用ATAC-seq技术在体外诱导NK细胞分化系统中检测NK细胞分化过程中染色质可及性的变化。对ATAC-seq数据的分析发现两个不同的转录因子(TF)簇动态调控NK细胞的分化。此外,来自第二个簇的两个TFs ,FOSL2和EGR2,被确定为调控NK细胞成熟和功能的新的必需转录因子。敲低这两个TF中的任何一个,都会明显影响NK细胞的分化。最后,我们构建了一个全基因组范围的转录调控网络,可以全面了解NK细胞的分化过程。
该研究工作得到了国家自然科学基金、国家科技部、中国科学院的资助。通讯作者为中国科学技术大学瞿昆和魏海明教授,共同第一作者为中国科学技术大学李坤和吴阳博士。
