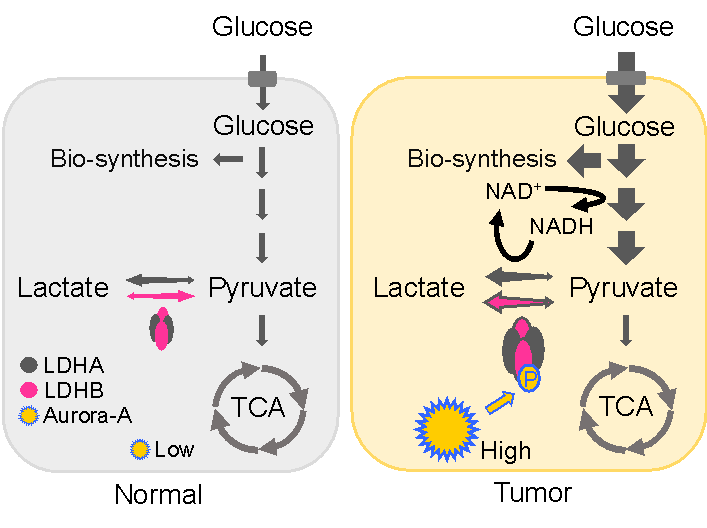
失控的恶性增殖是肿瘤细胞的根本特征,增殖过程需要伴随大量的生物合成。肿瘤细胞通过代谢重编程来满足大量的能量和物质需求,即在氧气充足的条件下,肿瘤细胞仍然会进行活跃的糖酵解 (Warburg effect)。通常认为主要分子机制是通过高表达葡萄糖转运蛋白(GLUT)以及乳酸脱氢酶A(LDHA)等来实现的,但是在很多肿瘤细胞中,和LDHA催化反应相反的亚基LDHB也是高表达的,为何肿瘤细胞需要高表达这种逆向反应的酶,逆向反应酶上调如何进行快速的糖酵解,这些看似“矛盾”的问题一直没有合理的解释。
近日合肥微尺度物质科学国家研究中心、生命科学与医学部、中科院天然免疫与慢性疾病重点实验室杨振业课题组发现在P53失活肿瘤中高表达的激酶Aurora-A可以在细胞周期的S期和G2期通过磷酸化LDHB上特定的位点,通过释放底物抑制效应逆转其催化反应的倾向性,促进糖酵解和细胞分裂前的生物合成,从而协助肿瘤细胞快速增殖。这一发现为解释上述矛盾提供了新思路。相关成果以“Aurora-A Mediated Phosphorylation of LDHB promotes glycolysis and tumor progression by relieving the substrate-inhibition effect”为题,发表于Nature Communications。
论文的通讯作者为杨振业教授和国静副研究员,中科大生命科学与医学部的博士后程傲星、杨冬冬,博士生张鹏,军事医学研究院王勃为论文的共同第一作者。该项工作还得到了军事医学研究院段小涛、潘欣课题组,中科大生命科学与医学部周丛照、张华凤、吴缅、高平、张志勇课题组,中科大一附院潘跃银课题组,华东理工大学杨弋、赵玉政课题组以及安医一附院吴强和王华课题组的大力帮助。
原文链接:https://www.nature.com/articles/s41467-019-13485-8
本研究也为靶向激酶Aurora-A的肿瘤精准治疗提供了新的思路。值得一提的是杨振业课题组和华南理工大学廉哲雄课题组合作发现Aurora-A的高效抑制剂可以直接重塑恶性乳腺肿瘤的免疫微环境并增加PD-L1阻断抗体的敏感性,从而达到更好的抗肿瘤效果,该工作在7月发表在Cancer Research,同期发表了领域专家的评述并重点推荐。该研究还得到了复旦大学柳素玲课题组,中科大一附院黄强、张开光、马小鹏和生医部马世嵩课题组的大力支持。这两部分研究为深入理解激酶Aurora-A在肿瘤发展和治疗中的作用提供了新机制。


以上研究在中科院、基金委、科技部、教育部等资助下完成。
(生命科学与医学部、中科院天然免疫与慢性疾病重点实验室和合肥微尺度物质科学国家研究中心、科研部)
