2019年1月15日,自然出版集团旗下《Nature Communications》杂志在线发表了中国科学技术大学生命科学与医学部基础医学院、中科院天然免疫与慢性疾病重点实验室和合肥微尺度物质科学国家研究中心田志刚院士课题组的研究论文“Breakdown of adaptive immunotolerance induces hepatocellular carcinoma in HBsAg-tg mice”。该研究在转基因小鼠中发现TIGIT抑制性通路维持了CD8+ T细胞对HBV的耐受,而打破这种耐受可以使HBV转基因小鼠(HBV携带模型)肝脏产成慢性炎症,最终发展成肝癌。
慢性乙肝(chronic HBV)感染可以导致慢性肝炎、肝硬化、甚至肝癌。而慢性HBV感染的研究一直缺乏合适的小鼠模型。肝脏是一个特殊的免疫耐受器官,肝脏中的免疫细胞主要呈现出免疫耐受状态。临床上的HBV携带者,以及HBV转基因小鼠中,肝脏中CD8+ T细胞由于高表达抑制性受体而处于免疫抑制状态,并无肝脏损伤产生;而当肝脏免疫耐受环境被打破,免疫细胞被激活,其在清除病毒的过程中引起的免疫应答能导致肝脏炎症的发生。
本研究发现HBV转基因(HBs-tg)小鼠肝脏高表达抑制性受体TIGIT, 通过持续性阻断TIGIT抑制性通路,可以使小鼠产生慢性肝炎。对TIGIT阻断后的小鼠进行HBV表面抗原疫苗免疫,小鼠可以产生肝癌。对机制进行探索,研究人员发现TIGIT阻断后HBs-tg小鼠肝脏中CD8+ T细胞数目增多,活化增强,并出现抗原特异性CTLs。清除CD8+ T细胞的HBs-tg小鼠阻断TIGIT后肝损伤明显减轻;若对TIGIT阻断后的HBs-tg小鼠在疫苗免疫期间清除CD8+ T细胞,则不会发展成为肝癌。综上所述,该研究发现TIGIT抑制性通路维持了HBV携带鼠中CD8+ T细胞的耐受,并且成功建立了一个由慢性HBV感染导致的肝癌小鼠模型,为后续深入研究HBV相关肝癌的预防和治疗提供了合适的动物平台。
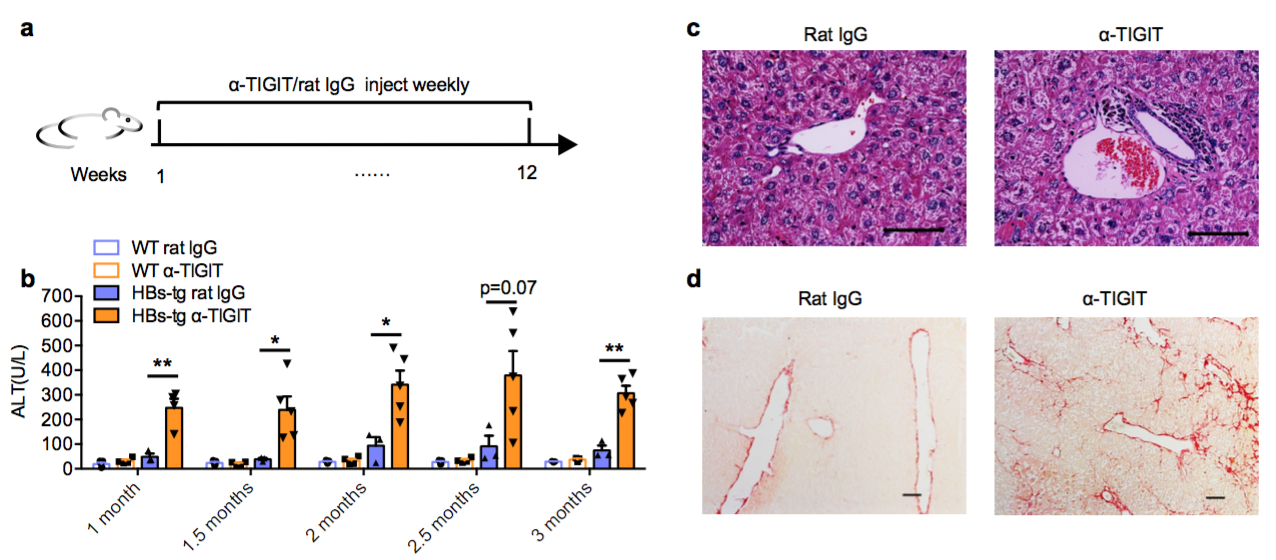
图:HBV转基因小鼠TIGIT阻断后产生慢性肝炎
该研究工作得到了国家重点研发计划、国家自然科学基金、中科院先导项目和重大专项的资助。通讯作者为中国科大田志刚院士,第一作者为中国科大宗璐博士。
论文链接:https://www.nature.com/articles/s41467-018-08096-8
